Team:KIT-Kyoto/Project/AbstractJ
From 2010.igem.org
 
|
Language : English / Japanese |
要旨
- "E.coli Pen": Draw with your own color.
- 私たちKIT-Kyotoは、新たなArt Toolとして「E.coli Pen」を提案します。このE.coli Penは大腸菌の菌液をインクとする全く新しいペンです。同じ一種類のインクで複数の色を創り出すことを最大の特徴とし、そのメカニズムには酸化ストレス応答機構を利用しています。私たちは、酸化ストレスを与えると蛍光タンパク質を発現する大腸菌を新たに作製しました。さらに、酸化ストレスへの応答が異なる様々なプロモーターを使ってそれぞれの下流域にある蛍光タンパク質の遺伝子発現の調節を行うことで、1種類の大腸菌に無限の色を作らせることに挑戦しました。私たちが作製したこのインクを用いたE.coli Penを使えば、これまでのiGEMにおけるBioartとは一味違う、「一般の人」が親近感を持って、純粋にScienceとArtを楽しむことができるようになると期待しています。
諸論
- 私たちKIT-Kyotoは、「科学をより身近に」というキーワードのもとにプロジェクトを進めてきました。
- 現在、理科離れは世界的に顕著な問題となっています。この傾向は、今後科学の発展に伴い、技術の高度化・複雑化が進めば進むほど強くなると予想されています。そこで、私たちはこのような問題を解決するために、普段、科学と接点のない人に科学に触れてもらう機会を提供しようと考えました。プロジェクトを進める上で、私たちが最も大切したのは、誰もが手軽に科学技術を楽しめるということです。さらに、本学(京都工芸繊維大学)の教育理念として「科学と芸術の出会い」すなわち、「科学」と「芸術」の2分野の融合というものが掲げられています。これらをヒントに私たちはバイオテクノロジーを用いて芸術作品を生み出す「バイオアート」に着目することにしました。
- >>バイオアートとは……
-
バイオアートとは、この10年程での生物学の躍進によって生まれた、全く新しい種類の芸術です。主に生物学の研究者が、細胞、DNA、ゲノム、タンパク質、酵素などを素材として、ゲノムエンジニアリングや組織培養といった最先端テクノロジーによって作ります。
現在では、バイオアートでは「生きているもの(living forms)」を用いて作らなければならないと言う考え方が一般的です。しかし、この「生きているもの」の定義は、未だ明確に決まっていません。 このように、バイオアートはまだ生まれたばかりの新しい芸術なのです。
しかし、既存のバイオアートは、バイオテクノロジーなどの専門的な設備・知識が必要なために一般の人が身近に使うことのできるものではなく、私たちの「科学をより身近に」というキーワードに合致しません。そこで私たちは、バイオアートを手軽に楽しめる新しいアートツールの開発に取り組みました。
- 私たちは、一つの大腸菌にインクとして作り出させた無数の色を持つE.coli Penという、今までにないアートツールを開発しました。このE.coli Penは、新しいアートツールとしてバイオアートの分野を発展させるだけでなく、発色の美しさや絵を描く楽しさとともに生命現象のシステムも学ぶことができる知育玩具としても役立ちます。
- E.coli Penの開発については以下の項目に分けて詳細に述べます。
1. どのようにして大腸菌に無数の色をつくらせるか?
- 1-1 光の三原色の利用
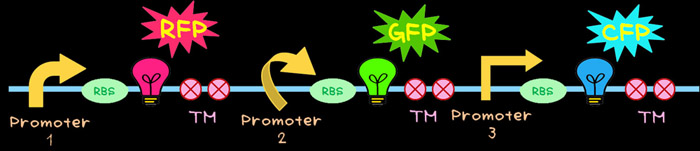
- 私たちは光の三原色(赤、緑、青)を利用することを考えました。色の素となるタンパク質には、蛍光タンパク質を使用しました。赤色はRFP、緑色はGFP、青色はCFPです。これらの蛍光タンパク質は紫外線を照射すると蛍光色を発し、レポーター遺伝子として遺伝子工学の分野ではすでに広く普及しています。これを用いて赤・緑・青の3色を大腸菌に作らせ、それぞれの色をつかさどるタンパク質の発現量を調節することにより、様々な比で赤・緑・青を混ぜ合わせ無数の色を作らせることができるのです。
- これを実現するために図のような遺伝子を新たにデザインしました。
- このマルチ遺伝子カセットで、RFP(赤)、CFP(緑)、CFP(青)をコードする遺伝子は縦列関係にあり、それぞれの遺伝子は、異なった活性を持つ異なったプロモーターによって制御されています。 無数の色を作るするためには、これらの蛍光タンパク質を異なった比率で作り出されなければなりません。 これは異なった活性を持つプロモーターを利用することによって達成できます。
- 1-2 適切な制御機構の選択
- では実際にどのようなプロモーターが適切なのでしょうか?人為的に発現量を調節するには、刺激や誘引物質が必要です。刺激や誘引物質の中でも手軽に使用することが可能で、閾値をもつプロモーターが複数あるものを私たちは始めに考えました。さらに、iGEMで未だ扱われていないもの、将来の医療の向上にも役立つようなものという観点も加えて探索しました。そうして、今回タンパク質発現の調節に利用したのが活性酸素です。活性酸素は、好気性細胞の通常の酸素呼吸によって生じるものであり、反応性が高く酸化力が強いものです。そのために生体内で過剰に発生すると核酸・脂質・タンパク質と結合し酸化させ、生体成分に損傷を与えてしまいます。これは様々な疾患の原因と考えられています。しかし、好気性生物は進化の過程で酸素の有効利用を獲得するとともに、酸素の利用により発生する活性酸素への防御機構も獲得してきています。今回私たちが利用したのはその防御機構です。
- 1-3 過酸化水素応答のメカニズム
- 大腸菌においても活性酸素に対する防御機構が存在しています。大腸菌には2通りの活性酸素への応答があります。一つはOxyR応答、もう一つはSoxRS応答です。
- OxyR応答で、OxyRの遺伝子産物は転写調節因子として働いています。これは通常状態では不活化であり機能しませんが、活性酸素に応答して活性化し特定のDNA配列に結合するようになります。この特定のDNA配列はプロモーター領域に含まれます。OxyRの遺伝子産物が結合するとそのプロモーターの転写が促進あるいは抑制されてプロモーターの下流のタンパク質の発現が調節されます。このようなOxyRの遺伝子産物が結合する領域をもつプロモーターの下流にある遺伝子は活性酸素に対する防御遺伝子であり、活性酸素を分解するような活性酸素を減らす能力を持ちます。これらの遺伝子の中で、私たちはEcoRⅠ、XbaⅠ、SpeⅠ、PstⅠによって切断されない遺伝子配列を持つahpC,dps.oxyR,sufA,yaiAのプロモーターに注目しました。これらの遺伝子のプロモーターをBiobrickサイトに記載されているpsB6A1にクローニングしました。
- SoxR応答はOxyR応答同様に恒性的に合成されているタンパク質です。SoxRは、SoxSのプロモーター領域に結合し、転写を阻害しています。しかし過酸化水素を付加するとSoxRは活性化し、SoxSの転写を開始させます。合成されたSoxSは複数の遺伝子の転写因子として機能を獲得します。これらの遺伝子の中でも私たちはEcoRⅠ、XbaⅠ、SpeⅠ、PstⅠによって切断されない遺伝子配列を持つacrAB,sodAのプロモーターに注目しました。これらの遺伝子のプロモーターをBiobrickサイトに記載されているpsB6A1にクローニングしました。
- 1-4 プロモーターについて
- AcrAB ,AhpC,dps,OxyR, SodA ,SufA,YaiAの7つの活性酸素応答性プロモーターの中でも、ahpC,sufAの機能をここで簡潔に述べたいと思います。
- AhpCプロモーター
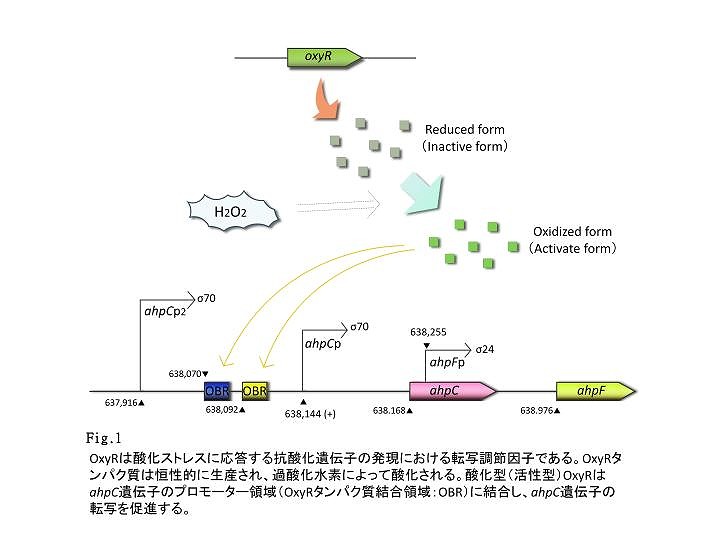
- ahpC-Fは酸化ストレス防御に関連する遺伝子です。これらの遺伝子の転写は過酸化水素応答によって制御されており、ahpCとahpFはアルキルヒドロペルオキシド還元酵素の小サブユニットと大サブユニットを、それぞれコードしています。そしてAhpCとAhpFは複合体を形成することで、アルキルヒドロペルオキシドを還元します。 ahpCプロモーターは酸化ストレス応答転写因子の1つであるOxyRによって支配されています。OxyRは恒性的に発現されるが、過酸化水素による酸化ストレス条件下において、初めて活性化されています。また活性型OxyRはahpCのプロモーター領域に結合し、転写を促進します。
- sufAプロモーター
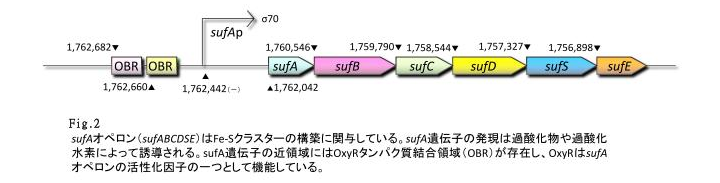
- sufAプロモーター;sufAプロモーターはOxyRを含めた幾つかの転写因子によって支配されており、それらの転写因子は大腸菌においてFe-S cluster assemblyシステムをコードするsufABCDSEオペロンの転写を制御しています。
- これらと、活性酸素濃度と大腸菌の生存率について調べることで(結果へのリンク)、私たちは大腸菌に無数の色を作り出せると考えました。
2. 活性酸素と大腸菌を効率よく混ぜるペンをどう作るのか?
- ノックの回数と強さによって、それぞれの溶液の抽出量を制御することで、E.coli Penは大腸菌と過酸化水素の混合率を変化させ、様々な色を作り出すことができます。できた色が意図した色でなければ、どちらかの液を足してやることにより、従来のペンでは不可能であった微妙な色の調整も可能です。
材料と方法
| 材料 | |
| 株 | |
| Esherichia coli | DH5 Alpha |
| プラスミド | |
| pSB3k3 | [http://partsregistry.org/wiki/index.php/Part:pSB3K3>>get more information] |
| pSB6A1 | [http://partsregistry.org/wiki/index.php/Part:pSB6A1>>get more information] |
| pSB1C3 | [http://partsregistry.org/wiki/index.php/Part:pSB1C3>>get more information] |
| pSB1A2 | [http://partsregistry.org/wiki/index.php/Part:pSB1A2>>get more information] |
| pSB1AK3 | [http://partsregistry.org/wiki/index.php/Part:pSB1AK3>>get more information] |
| pSB4A5 | [http://partsregistry.org/wiki/index.php/Part:pSB4A5>>get more information] |
| 方法 | |
| 基本的なプロトコルを以下に示す。 詳細は各項目をクリック。 | |
| リスト | |
| トランスフォーメーション | >>Go protocol |
| アルカリミニプレップ | >>Go protocol |
| ポリメラーゼ連鎖反応(PCR) | >>Go protocol |
| 制限酵素処理 | >>Go protocol |
| アガロースゲル電気泳動 | >>Go protocol |
| ゲルからのDNA抽出 | >>Go protocol |
| ライゲーション | >>Go protocol |
| Culture media | |
| LB培地 | >>Go protocol |
| 2xYT培地 | >>Go protocol |
| SOB培地 | >>Go protocol |
| SOC培地 | >>Go protocol |
結果と考察
活性酸素による大腸菌の生存曲線について
<背景>
- E.coli Pen製作にあたって、E.coli PenのインクにH2O2反応系の大腸菌(DH5α)を用いました。
しかし、高濃度のH2O2は大腸菌に対して濃度依存的毒性を示すことが知られています。 そこで、効率的にH2O2反応系を利用するために、大腸菌(DH5α)の生存曲線を調べ、大腸菌(DH5α)が死滅しない程度のH2O2濃度を求めることにしました。
<実験方法>
- 1日目
- ・DH5αの培養
- プレートからシングルコロニーを滅菌した爪楊枝でピックアップしました。
- ↓爪楊枝でピックアップしたコロニーをテストチューブに入れた2mlのLB(amp-)液体培地に移し、37℃で振盪培養しました(overnight)。
- 2日目
- 前日にプレカルチャーした培養液2mlにLB液体培地 28mlを加えて希釈し、吸光度を計りました。
- ↓DH5αをO.D.600=0.4~0.6になるまで37℃で振盪培養しました。
- ↓培養後、培養液を2mlずつ分注し、終濃度が1mM,100μM,10μM,1μM,100nM,10nM,1nM,
- 100pM,10pM,1pMになるようにH2O2を加え、37℃で振盪培養しました(1時間)。
- ↓1時間後、培養液1μlに対してLB液体培地を1ml加えて希釈し、希釈した培養液10μlをLBプレート(amp-)にまき、37℃で培養しました(overnight)。
- 3日目
- プレートのコロニーの数を数え、生存曲線のグラフを作成しました。
<実験結果>
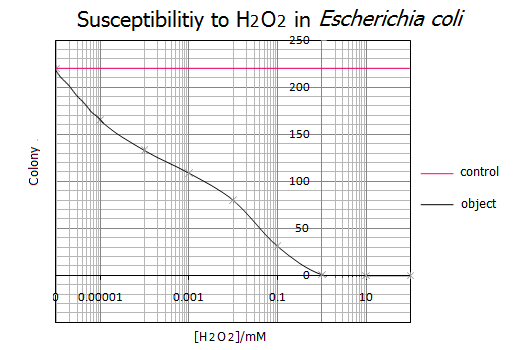
- 得られたグラフより、大腸菌のH2O2による致死濃度は1mMである事がわかりました。一方、H2O2濃度が0.000001mM(=1nM)以下だと大腸菌の生存に影響を与えないことがわかりました。以上の結果からH2O2濃度が1nM~1mMの範囲を基準として使用し、次にH2O2応答プロモーターの活性度合を調べることにしました。
- また、この実験結果は実験を5回行って、その統計をもとにしているので実証性が十分にあるといえます。
<引用文献>
- 以下の引用文献を参考に、得られた結果は正しいと判断しました。
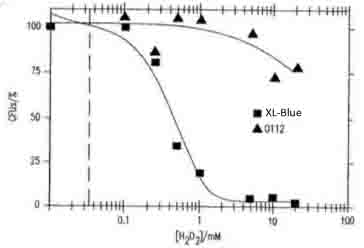
- 図17Bは、大腸菌XL1-ブルーおよび0112a,c血清型の生存能力に対するH2O2の濃度依存的毒性を示す。
- 桂川国際特許事務所「抗体または好中球を介するオゾン生成」(P2004-551020)
- 参考文献より、大腸菌のH2O2による致死濃度が1~0.9mMであること、ある一定のH2O2濃度を超えると急激に大腸菌の生存率が下がることがわかる。
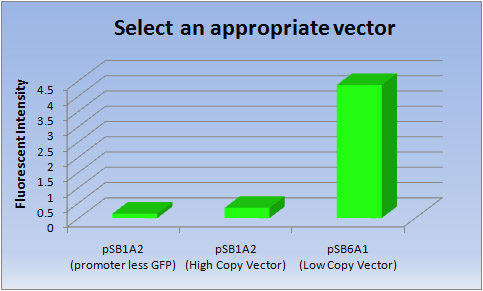
適切なベクターの選択について
- E.coli Penを作る際に、我々は、「インク」の選択が重要であると考えた。 文字を書いたり、絵を描くことに注目したE.coli PenはiGEMの最初の試みであるので、私たちは「インク」(蛍光タンパク質)を生産するために適切なベクターを選択することから始めるべきだと考えた。 「インク」として、長期間はっきりと書き続けることできることが必要である。したがって、私たちは高い転写効率をもつ発現ベクターを選択した。
- 一般に、pSB6は、それを高コピーベクターよりタンパク質生産に適する低コピープラスミドである。 しかしながら、iGEMに関連するどんなサイトでもこの情報を見つけることができなかった。 なので、私たちは高コピーベクターpSB1と低コピーベクターpSB6の性能を比較した。
- <結果>
ベクター 蛍光強度 pSB1A2(promoter less GFP) pSB1A2(高コピーベクター) pSB6A1(低コピーベクター) 1 0.145 0.349 4.33 2 0.146 0.324 4.34 3 0.146 0.328 4.42 Ave 0.146 0.337 4.36
活性酸素の検出感度について
ahpC
<結果と考察>
- 私たちは、ahpCプロモーターによる蛍光タンパク質発現系を設計し、この発現系ベクターをDH5αコンピテントセルに形質転換しました。そして、以下に示すように、過酸化水素を付加した細胞の蛍光強度測定を行いました。
- 37℃下において、細胞を1nM~1mMの過酸化水素で処理し、10分毎に80分までの蛍光強度を測定しました。LB培地は自家蛍光が生じるため、対数増殖期にある大腸菌をOD600=0.5に保ち、PBSに懸濁しました。
- Figure 1 はahpCプロモーターが過酸化水素に対して濃度依存的に応答し、また経時的にその活性が増大していることを示しています。特に過酸化水素濃度10μM~1mM、処理後40分から70分において蛍光強度は著しく増大しました。また、処理後70分以降、蛍光強度の増大傾向は見られなくなりました。
- 今回、私たちが得た結果は極めて理想的で、過酸化水素による濃度的、時間的な蛍光タンパク質の発現調節が可能であることを示唆しています。従って、私たちはこの発現系により、極めて多くの色をつくり得ると考えられます。私たちの発現システムはE.coli Penの開発にとって、間違いなく強力なツールとなります。
sufA
<結果>
- 私たちはsufAプロモーターに関しても、蛍光タンパク質発現系を設計し、蛍光強度の測定を行いました。
- Figure 2 はsufAプロモーターが過酸化水素に対して濃度依存的に応答していることを示しています。
<考察>
- sufAプロモーター領域はsufAオペロンの上流に位置し、SufAタンパク質は足場タンパク質として機能しています。SufAタンパク質は極めて短時間で発現量の最大値に達し、sufAプロモーターは少なくとも処理後、80分まではその活性を増大、維持しました。また私たちは、sufAプロモーターの濃度依存的な活性はSufAタンパク質の発現量にも反映されるものと推測しています。
インクの作製について
<結果と考察>
- 結果と考察はニ項目あります。様々な色によるインクの作成について、そして作成したインクを使って描いた実際の芸術作品についてです。
(A) PBS UV照射なし (B) LB UV照射なし(C) PBS UV 照射下 (D) LB培地 UV照射下
最初、私たちは溶媒としてLB培地を使用していましたが、インクの色がLB培地の高い自家蛍光によって明瞭ではありませんでした。よって、バイオアートによりよい溶媒を見つけるために、様々な溶媒を試してみました。図1はPBS とLB培地の比較を示しています。図1C,Dが示している通り、PBSはLB培地よりも低い自家蛍光を示しました。比べた結果、PBSが大腸菌の細胞に最良な溶媒であったので、PBSをE. coli ペンの溶媒としました。
試行錯誤の結果、私たちは赤色やオレンジ色、黄色や緑色を作成することに成功しました。さらに、緑色と赤色を混ぜることで様々な色を作り出すことに成功しました。
(A)赤色インク、UV照射下でのRFP (B) 緑色インク、UV照射下でのGFP (C) 黄色インク、UV照射下でRFP:GFP比率1:2
緑色インクと赤色インクの作成には、psB6A1をベクターとして利用したK362001とpsB1C3をベクターとして利用したJ04450をそれぞれ使いました。そして、オレンジや黄色といった他の色のインクを作るために、緑色インクと赤色インクを混ぜました。黄色インクは赤色インクと緑色インクを1:2で混ぜることでできます(図2)。
(A)赤色インク (B)オレンジインク (C)黄色インク (D)緑色インク (E)PBS UV照射下
また、オレンジ色は緑色インクと赤色インクを1:2の比率で混ぜることで作られます。この他にも、インクの混ぜる比率を変えることで様々な色を作ることができます。
E.coli Penを用いた芸術作品について
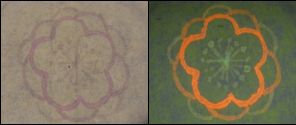
- 最初、私たちは描くための用紙として新聞紙を使用しようと考えました。しかし、新聞紙は自家蛍光が強く、バイオアートには向かないとわかりました(図4)。実際、新聞紙の上にバイオインクで描いてみたところ、鮮明ではありませんでした。したがって、私たちはバイオアートに向いたよりよい用紙の探索をおこないました。図4が示す通り、研究室で一般的に使われているティッシュ、キムワイプは自家蛍光をほとんど持ちませんでした。では、なぜ用紙が自家蛍光を持つのでしょうか?よく知られているのはリグニンです。リグニンは木材が本来持っている成分であり、強い自家蛍光を持ちます。そして、いくつかの用紙はリグニンを豊富に含んでいます。この理由で、いくつかの用紙が強い自家蛍光を持ちます。一方でキムワイプは自家蛍光をほとんど持ちません。したがって、私たちはE.coli ペンによるバイオアートのための用紙としてキムワイプが最良の物であるという結論に至りました。
(A)新聞紙 (B)キムワイプ UV照射下
バイトインクとキムワイプを用いて、私たちはたくさんの絵や文章などを描きました。この後、示すのはいくつかの作品例です。新しいツールで生み出されたバイオアートは無限の可能性を秘めています。
- インクと用紙を使ってサンプルを作りました。次に示すのはそのサンプルです。
参考文献
- [http://www.ncbi.nlm.nih.gov/pubmed/11443092 PMID: 11443092] Ming Zheng, Xunde Wang, Bernard Doan, Karen A. Lewis, Thomas D. Schneider, Gisela Storz,Computation-Directed Identification of OxyR DNA Binding Sites in Escherichia coli,Journal of Bacteriology,2001 Aug;183(15):4571-79.
- [http://www.ncbi.nlm.nih.gov/pubmed/10913087 PMID: 10913087] Urs A. Ochsner, Michel L. Vasil, Eyad Alsabbagh, Kislay Parvatiyar, Daniel Hassett,Role of the Pseudomonas aeruginosa oxyR-recG operon in oxidative stress defense and DNA repair: OxyR-dependent regulation of katB-ankB, ahpB, and ahpC-ahpF.,Journal of Bacteriology,2000 Aug;182(16):4533-44.
- [http://ci.nii.ac.jp/naid/110001710476 NAID: 110001710476] 布柴 達夫,大腸菌の活性酸素防御応答と突然変異誘発機構に関する研究,Environmental mutagen research,2001 June 30;23(1):23-32.
- [http://www.ncbi.nlm.nih.gov/pubmed/12876288 PMID: 12876288] Laurent Loiseau, Sandrine Ollagnier-de-Choudens, Laurence Nachin, Mare Fontecave, Frederie Barras,Biogenesis of Fe-S cluster by the bacterial Suf system: SufS and SufE form a new type of cysteine desulfurase.,The Journal of Biological Chemistry,2003 Oct 3;278(40):38352-9.
- [http://www.ncbi.nlm.nih.gov/pubmed/18849427 PMID: 18849427] Joon-Hee Lee, Won-Sik Yeo, Jung-Hye Roe,Induction of the sufA operon encoding Fe-S assembly proteins by superoxide generators and hydrogen peroxide: involvement of OxyR, IHF and an unidentified oxidant-responsive factor.,Molecular Microbiology,2008 Dec;190(24):8244-7.
- [http://www.ncbi.nlm.nih.gov/pubmed/16621810 PMID: 16621810] Ramakrishnan Balasubramanian, Gaozhong Shen, Donald A. Bryant, John H. Golbeck,Regulatory Roles for IscA and SufA in Iron Homeostasis and Redox Stress Responses in the Cyanobacterium Synechococcus sp. Strain PCC 7002.,Journal of Bacteriology,2006 May;188(9):3182-91.
- [http://www.ncbi.nlm.nih.gov/pubmed/11443091 PMID: 11443091] Zheng M, Wang X, Templeton LJ, Smulski DR, LaRossa RA, Storz G.,DNA microarray-mediated transcriptional profiling of the Escherichia coli response to hydrogen peroxide.,Journal of Bacteriology,2001 Aug;183(15):4562-70.
- [http://www.ncbi.nlm.nih.gov/pubmed/12889026 PMID: 12889026] Lu C, Bentley WE, Rao G.,Comparisons of oxidative stress response genes in aerobic Escherichia coli fermentations.,Biotechnology and Bioengineering,2003 Sep 30;83(7):864-70.
- [http://ci.nii.ac.jp/naid/110000056227 NAID: 110000056227] 武部 聡、東 恵実、吉田 恵、吉田 あや,cAMP-CRP制御系のsodAプロモーター活性に与える影響,京都女子大学食物學會誌,1995 Dec 10;50:37-42.
- [http://www.ncbi.nlm.nih.gov/pubmed/10585871 PMID: 10585871] Mitsumoto A, Kim KR, Oshima G, Kunimoto M, Okawa K, Iwamatsu A, Nakagawa Y.,Glyoxalase I is a novel nitric-oxide-responsive protein.,The Biochemical journal,1999 Dec 15;344 Pt 3:837-44.
- [http://www.ekouhou.net/%E6%8A%97%E4%BD%93%E3%81%BE%E3%81%9F%E3%81%AF%E5%A5%BD%E4%B8%AD%E7%90%83%E3%82%92%E4%BB%8B%E3%81%99%E3%82%8B%E3%82%AA%E3%82%BE%E3%83%B3%E7%94%9F%E6%88%90/disp-A,2006-506613.html PCT/EP2003/012710] Novartis, The Scripps Research Institute,抗体または好中球を介するオゾン生成,2004 May 27.
 "
"