Team:HokkaidoU Japan/Notebook/August12
From 2010.igem.org
(Difference between revisions)
(→Electrophoresis 1) |
(→mini prep) |
||
| Line 10: | Line 10: | ||
<div style="clear:both"></div> | <div style="clear:both"></div> | ||
| - | = | + | =Mini prep= |
| - | * | + | * Used cells incubated for 18h in LB broth |
| - | ** 1- | + | ** 1-18F didn't grow well |
| - | * | + | * Centrifuge after adding 430 uL of chloroform、collected supernatant |
| - | * 1- | + | * Added 2-propanol to 1-18F, but after centrifugation there were no precipitation |
| - | * | + | ** Melted in 30 uL of TE and did electrophoresis |
=電気泳動2= | =電気泳動2= | ||
Revision as of 06:40, 20 September 2010
Electrophoresis 1
- Checked the result of yesterdays ligation of PCR products by electrophoresis
- Added 4 uL of 6x Sample Buffer to make 12 uL in total
- Used 20uL of EtOh
Mini prep
- Used cells incubated for 18h in LB broth
- 1-18F didn't grow well
- Centrifuge after adding 430 uL of chloroform、collected supernatant
- Added 2-propanol to 1-18F, but after centrifugation there were no precipitation
- Melted in 30 uL of TE and did electrophoresis
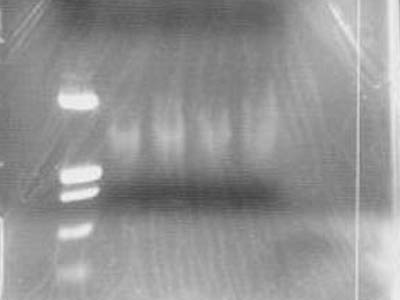
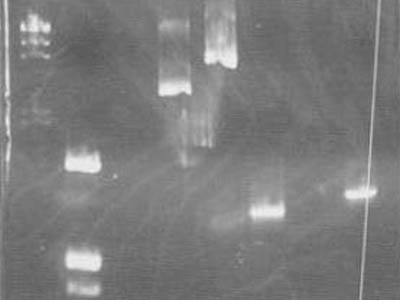
電気泳動2
mini prepで得たプラスミドとPCRで得たパーツのDNAを電気泳動で確認した
制限酵素処理はしないので、反応系は以下の通り
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Parts | 1-18F | 2-21H | 2-11P | 2-24G | 1-2M | 3-1E |
| DNA solution | 2 uL | 2 | 2 | 1 | 1 | 1 |
| 6x Sample Buffer | 0.4 uL | 0.4 | 0.4 | 0.4 | 0.4 | 0.4 |
- マーカーはλ/HindIIIとpUC119/HinfIを使用
- レーン1のマーカー(λ/HindIII)はウェルから流れ出てしまった
- レーン3(mini prepのサンプル,1-18F)はバンドが確認できなかった(後日PCR)
- レーン4ではplasmidのダイマー,トライマーがよく確認できる(plasmidの電気泳動ではよくあるらしい)
 "
"